|
范德华力(必修2、选修3)<-->各种化学键的比较(选修3)
氢键(选修3)
〖定义〗
氢键是介于化学键和范德华力之间的一种相互作用。存在于氢原子和非金属性较强、原子半径小的原子所形成的化合物分子间。
〖特征〗
氢键表示为X—H···Y(其中X和Y代表非金属性较强、原子半径小的原子,如N、O、F,X和Y可以相同,也可以不同,“—”表示共价键,“···”表示氢键)
〖影响因素〗
氢键比化学键弱得多,但比范德华力强。
形成氢键的强弱与元素的电负性有关,与氢核的外露程度以及与氢相连原子上的孤电子对的电子云密度高低有关。氢键强弱的一般顺序是:F----H···F> O---H···N>O---H···O>N----H···N
〖分类〗
分子内氢键:同一分子内部形成的氢键叫分子内氢键。如邻硝基苯酚
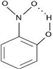
分子间氢键:分子与分子间形成的氢键叫分子间氢键。包括同分子间氢键: HF···HF(氟化氢分子之间);异分子间氢键:H3N···HOH(水分子和氨分子之间)
〖对物理性质的影响〗
分子内氢键削弱分子间力,使化合物的熔沸点降低;
分子间氢键增强分子间作用力,导致化合物的熔沸点升高。
如果溶质分子和溶剂分子间能形成氢键,就会促进分子间的结合,导致溶解度增大
|

